邓宏魁cell 北京大学邓宏魁连发Science Cell子刊文章获干细胞新进展
被聘为北京大学生命科学院特聘教授,长江学者的邓宏魁教授,自2000年在北京大学建立了细胞分化与干细胞研究室,主要进行干细胞增殖分化的分子机理以及抗体工程等方面的研究。近期其研究组与其他研究组合作,接连发表Science,Cell Stem Cell文章,取得了干细胞研究领域的新进展。
首先在“Directed Differentiation of Human Embryonic Stem Cells into Thymic Epithelial Progenitor-like Cells Reconstitutes the Thymic Microenvironment In Vivo”这篇文章中,邓宏魁教授等人成功利用人胚胎干细胞培养出人胸腺祖细胞,经体内移植可形成功能性的胸腺组织。
胸腺作为T细胞发育成熟的主要部位,是人体最重要的免疫器官之一。胸腺移植在治疗免疫相关疾病方面有广泛的应用潜力,如治疗DiGeorge综合症等免疫缺陷疾病、诱导对移植器官的免疫耐受等。目前成熟的临床胸腺移植方案虽已建立,但是胸腺组织供体的缺乏却极大地限制了胸腺移植的临床应用。
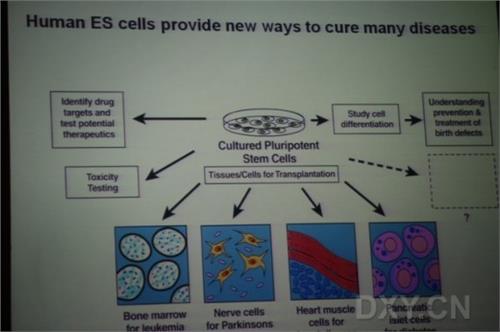
人胚胎干细胞由于具有分化为人体内几乎所有细胞类型的能力和体外无限增殖的特性,理论上可以提供大量的人胸腺细胞用于临床胸腺移植。然而,人胚胎干细胞能否在体外定向分化形成功能性的胸腺细胞,是人多能干细胞定向分化领域的一个长期未解决的问题。
在这篇文章中,研究人员成功地在体外分化过程中模拟了体内的胸腺发育途径,建立了人胚胎干细胞向胸腺祖细胞定向分化的诱导体系。将分化获得的胸腺祖细胞移植到裸鼠体内,可进一步成熟分化形成胸腺皮质和髓质上皮细胞。更为重要的是,由此形成的胸腺上皮组织可支持小鼠功能性T细胞的发育成熟,并在人源化小鼠模型中能有效促进人T细胞的形成。
这一研究工作首次证明了人胚胎干细胞可定向分化为功能性的人胸腺祖细胞,不仅为研究人体胸腺发育提供了一个重要的体外研究平台,而且为胸腺移植的临床应用提供了新的细胞来源,给未来基于胸腺的再生医学治疗相关疾病带来了新的可能。
另外邓宏魁教授和赵扬博士带领的研究团队还在Science杂志上发表文章,用小分子化合物诱导体细胞重编程为多潜能干细胞。这一成果开辟了一条全新的实现体细胞重编程的途径,给未来应用再生医学治疗重大疾病带来了新的可能。
研究人员仅使用四个小分子化合物的组合对体细胞进行处理就可以成功的逆转其“发育时钟”,实现体细胞的“重编程”。使用这项技术,他们成功的将已经特化的小鼠成体细胞诱导成为了可以重新分化发育为各种组织器官类型的“多潜能性”细胞,并将其命名为“化学诱导的多潜能干细胞(CiPS细胞)”。
这个新方法摆脱了以往技术手段对于卵母细胞和外源基因的依赖,避免重编程技术进一步应用所遭受的一些质疑,例如破坏胚胎或基因突变风险等。这项成果提供了更加简单和安全有效的方式来重新赋予成体细胞 “多潜能性”,是体细胞重编程技术的一个飞跃,这为未来细胞治疗及人造器官提供了理想的细胞来源。
这项新技术让人惊奇的是,原本人们认为复杂而严密的分化发育过程竟然可以通过如此简单的方式实现逆转。为了明确化学诱导的体细胞重编程过程发生的机制,邓宏魁研究组还进一步研究了这一过程中的分子水平的路径。结果显示“化学诱导的体细胞重编程”的过程是一条有别于以往体细胞重编程方法的全新途径。更有意思的是,这条新途径的早期变化过程同低等动物再生的早期过程中所涉及的分子机制比较类似。