【国产美罗华】首款国产美罗华获批上市!
2月22日,上海复星医药控股子公司复宏汉霖自主研发的生物类似药利妥昔单抗(HLX-01)获批上市,商品名汉利康,这是首个获批的美罗华(利妥昔单抗)生物类似药,主要用于 CD20阳性非霍奇金淋巴瘤的治疗。笔者根据复宏汉霖21届CSCO的公开资料,详述了利妥昔单抗生物类似药注册临床试验数据。
首个国产美罗华上市
复宏汉霖2009年启动该利妥昔单抗生物类似药项目,历时近10年,研发已累积投入3.3亿元。2017年10月30日,CFDA受理复宏汉霖利妥昔单抗生物类似药上市申请(CXSS1700026),该审评纳入第26批优先审评目录,历时300天,利妥昔单抗首款生物类似药获批上市。

关键3期临床数据:HLX-01的3期临床研究是一项随机、双盲、平行对照的多中心(33家)临床试验(CTR20150583,NCT02787239),该研究招募患者407例,评价生物类似药与原研药作为弥漫型大B非霍奇金淋巴瘤一线疗法的安全性和有效性。
数据证实:HLX-01与原研药(美罗华®)在治疗CD20阳性弥漫型大B非霍奇金淋巴瘤初治患者的临床试验主要终点、次要终点(安全性、免疫原性、药代动力学)均达到预设标准。

试验设计:
药代动力学:HLX01 VS 美罗华无统计学差异
安全性:HLX01 VS 美罗华无统计学差异
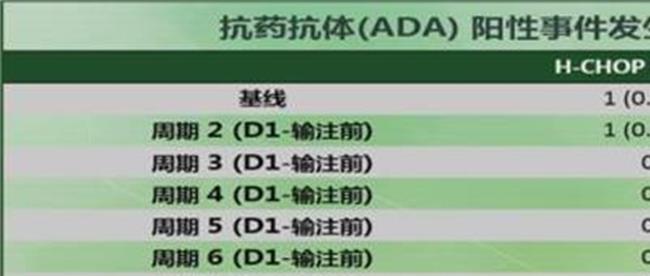
免疫原性:HLX01 VS 美罗华无统计学差异
利妥昔单抗注射液与原研药(美罗华®)在治疗CD20阳性弥漫型大B非霍奇金淋巴瘤初治患者的临床试验主要终点、次要终点(安全性、免疫原性、药代动力学)均达到预设标准。
该利妥昔单抗生物类似药的上市是一个里程碑式的进展,这是国内肿瘤领域首个生物类似药,国家癌症中心2015年数据显示,中国淋巴瘤患者8.8万例,88%为非霍奇金淋巴瘤,8.5%为经典霍奇金淋巴瘤。此时,罗氏美罗华(利妥昔单抗)已在中国走过18年,2017年,医保谈判后,罗氏美罗华降价58.45%,但是患者负担依旧很重,年费用在18万左右,期待国产美罗华能够惠及更多患者。