黄晓龙含量 含量测定分析方法验证的可接受标准简介黄晓龙
国家食品药品监督管理局药品审评中心-电子刊物 发布日期 20060120 栏目 化药药物评价>>化药质量控制 标题 含量测定分析方法验证的可接受标准简介 作者 黄晓龙 部门
正文内容 审评四部 黄晓龙 摘要:本文介绍了在对含量测定所用的分析方法进行方法学验证时,各项指标的可接受 标准,以利于判断该分析方法的可行性。 关键词:含量测定 分析方法验证 可接收标准 在进行质量研究的过程中,一项重要的工作就是要对质量标准中所涉及到的分析方法进 行方法学验证, 以保证所用的分析方法确实能够用于在研药品的质量控制。
为规范对各种分 析方法的验证要求,我国已于 2005 年颁布了分析方法验证的指导原则。
该指导原则对需要 验证的分析方法及验证的具体指标做了比较详细的阐述。 但是文中未涉及各具体指标在验证 时的可接受标准,国际上已颁布的指导原则中也未发现相关的要求。另一方面,大多数药品 研发单位在进行质量研究时, 已逐步认识到分析方法验证的必要性与重要性, 大都也在按照 指导原则的要求进行分析方法验证, 但验证完后却因没有一个明确的可接受标准, 而难以判 断该分析方法是否符合要求。
本文结合国外一些大型药品研发企业在此方面的要求, 提出了 在对含量测定方法进行验证时的可接受标准,供国内的药品研发单位在进行研究时参考。 1.准确度 该指标主要是通过回收率来反映。 验证时一般要求分别配制浓度为 80%、 100%和 120% 的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。
可接受的标准为: 各浓度下的平均回收率均应在 98.0%-102.0%之间, 9 个回收率数据的 相对标准差(RSD)应不大于 2.
0%。 2.线性 线性一般通过线性回归方程的形式来表示。具体的验证方法为: 在 80%至 120%的浓度范围内配制 6 份浓度不同的供试液,分别测定其主峰的面积,计 算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。 可接受的标准为:回归线的相关系数(R)不得小于 0.998,Y 轴截距应在 100%响应值 的 2%以内,响应因子的相对标准差应不大于 2.
0%。 3.精密度 1)重复性 配制 6 份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所 得 6 份供试液含量的相对标准差应不大于 2.0%。
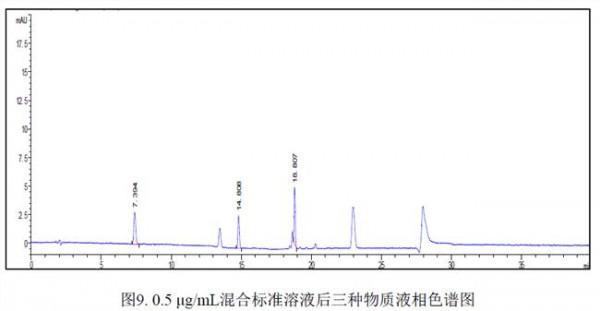
2)中间精密度 配制 6 份相同浓度的供试品溶液, 分别由两个分析人员使用不同的仪器与试剂进行测试, 所得 12 个含量数据的相对标准差应不大于 2.0%。 4.专属性 可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得 小于 2.
0。以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于 980。 5.检测限 主峰与噪音峰信号的强度比应不得小于 3。 6.定量限 主峰与噪音峰信号的强度比应不得小于 10。
另外,配制 6 份最低定量限浓度的溶液,所 测 6 份溶液主峰的保留时间的相对标准差应不大于 2.0%。 7.耐用性 分别考察流动相比例变化± 5%、流动相 pH 值变化± 0.
2、柱温变化± 5℃、流速相对值变 化± 20%时,仪器色谱行为的变化,每个条件下各测试两次。可接受的标准为:主峰的拖尾 因子不得大于 2.0,主峰与杂质峰必须达到基线分离;各条件下的含量数据(n=6)的相对 标准差应不大于 2.
0%。 8、系统适应性 配制 6 份相同浓度的供试品溶液进行分析,主峰峰面积的相对标准差应不大于 2.0%,主 峰保留时间的相对标准差应不大于 1.0%。另外,主峰的拖尾因子不得大于 2.0,主峰与杂 质峰必须达到基线分离,主峰的理论塔板数应符合质量标准的规定。