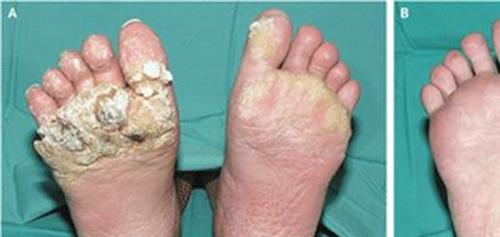
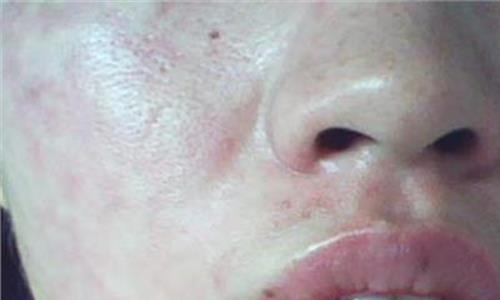
他克莫司中美华东 他克莫司胶囊
本品主要成份为他克莫司,化学名称为:17-烯丙基-1,14-二羟基-12-[2-(4-羟基-3-甲氧基环己基)-1-甲基乙烯基]-23,25-二甲氧基-13,19,21,27-四甲基-11,28-二噁-4-氮杂环[22.3.1.04,9]二十八烷-18-烯-2,3,10,16-四酮。
本品为硬胶囊,内容物为白色或类白色粉末。
药理作用药物治疗学分类:免疫抑制性大环内脂类。在分子水平,本品的作用似乎是由细胞质内与之结合的蛋白FKBP12介导的。FKEP12使得本品进入细胞内,并形成复合物,该复合物竞争性地与钙调素特异性地结合并抑制钙调素,后者介导T细胞内-钙依赖性抑制性信号传递系统,从而阻止一系列淋巴因子基因转录。

药效作用体内外实验证明,本品是一强效的免疫抑制剂。本品抑制细胞毒淋巴细胞的形成,移植排斥反应主要是由后者引起。
该药抑制T细胞活化及TH细胞依赖性的B细胞增殖,以及淋巴因子的生成如白细胞介素2,白细胞介素3及β-干扰素,以及白细胞介素-2受体的表达。体内研究表明,本品对肝和肾移植均有效。毒理研究1 、急性毒性实验大鼠口服的LD50为134mg/kg(雄性)和194mg/kg(雌性),最小致死剂量雌雄均为100mg/kg。

静脉给药的LD50分别为57mg/kg(雄性)和23.6mg/kg(雌性),最小致死剂量为32mg/kg(雄性)和18mg/kg(雌性)。
狒狒,单剂量口服250mg/kg,仅导致轻微的急性中毒表现。静脉给药50mg/kg后,即可观察到急性休克症状。2 、长期毒性实验大鼠和狒狒的慢性毒性实验表明,本品口服剂量分别为1.

5和10.0mg/kg/day,静脉剂量分别为0.32和1.0mg/kg/day,观察到轻微的、可逆转的肾毒性。而且,观察到胰腺的内分泌部分有损伤。这种改变同样是可逆的。
大鼠和狒狒的最小口服毒性剂量分别为1.5和10.0mg/kg/day,静脉毒性剂量分别为0.1和0.5mg/kg/day。在大鼠身上,剂量高于0.5mg/kg/day观察到对眼和外周神经的轻微的毒性,而当剂量高于3.
2mg/kg/day将影响到中枢神经系统。在兔中观察到对静脉给药的本品特别敏感。当剂量高于2×0.05mg/kg/day时,即观察到心脏中毒效应。3 、致突变性相关体内及体外试验表明,本品没有任何潜在的致突变性。
4 、致癌性在为期一年的慢性毒性实验(小鼠和狒狒中),以及长期致癌性实验中(大鼠18个月,小鼠24个月)。本品未显示出任何直接致癌危险。但从其他免疫抑制剂的经验来看,极少数病人有发生淋巴瘤及皮肤癌的可能。
5 、生殖毒性在小鼠试验中,受孕、胚胎及幼仔的发育、出生及围产期前后的发育,只有在给予明显的中毒剂量(3.2mg/kg/日)后才有所损害。唯一的例外是,在给予日剂量0.
1mg/kg的本品时,幼仔出生时的体重出现可逆性地下降。进一步在兔子中进行的试验也观察到了对胚胎及幼仔的毒性反应。但也仅限于日剂量1.0mg/kg,且母体也出现了明显的毒副反应。据此,本品不应给予孕妇。
据文献资料:吸收:对小鼠的研究表明,他克莫司主要吸收部位在胃肠道上部。口服后本品在胃肠道的吸收不完全,且差异较大。口服后有些患者吸收迅速,在0.5小时内达峰。在某些患者,药物似乎是在一较长时间内连续吸收,或多或少地呈现出平台吸收效应。
因为低水溶性和胃动力的改变,而使本品在胃中溶出不好,可能部分解释观察到的现象。肾移植患者单次口服0.10,0.15和0.20mg/kg的木品,血中峰值浓度分别为19.2,24.
2,47.9ng/ml,达峰时间从0.7小时到6小时。他克莫司胶囊的平均生物利用度在肝移植患者中约为21.8%,肾移植患者约为20.1%,健康自愿者为14.4-17.4%。当进食中等程度的脂肪餐后再给药,本品的口服生物利用度下降。
AUC下降(全血为27%,血浆为35%)和Cmax下降(全血为50%,血浆为57%),Tmax增加(全血和血浆均为173%)。当与食物一起服用时,本品的吸收率及程度均有所下降。
胆汁对本品的吸收无影响,因此对肝移植患者实行口服给药或早期即从静脉给药转为口服给药是可行的。分布和消除本品广泛分布于体内,和红细胞及血浆蛋白高度结合。本品静脉输注结束时即达到血浆峰浓度。
输注结束后浓度迅速下降,说明该药迅速分布血浆外室。当分布达到平衡后,本品浓度缓慢下降。移植患者静脉输注本品后的药代动力学可描述为二室模型。肾移植患者单次口服本品后AUC和Cmax随口服剂量的增加而成比例增加。
肝移植患者平均谷值浓度在移植后6个月维持相对稳定。根据移植患者的血浆学数据,本品表观分布容积平均为1342L,提示该药在体内分布广泛。肝移植患者,根据全血浓度,平均表观分布容积为64.4L(标化为体重时为0.
85L/kg体重),根据血浆浓度,平均表观分布容积为1094.5L(标化为体重时为16.1L/kg体重)。曲线下面积与稳态血药浓度的变化范围具有强相关性。因此监测血药浓度波动范围能很好地估计全身药物接触情况。
在鼠、狗、猴和人体内该药与血浆蛋白高度结合(>98.8%)。全血/血浆比大约为20:1(健康自愿者)。本品与红细胞紧密结合。该作用和温度相关,低温导致低的血浆浓度。肝移植患者口服(0.
15mg/kg,bid)后,多数病人在三天内达到稳态血药浓度。本品半衰期长,差异大,清除率低。健康自愿者平均总体清除量大约为2.43L/h(1.88-3.0L/h),肝移植患者总体清除量为4.
1L/h(1.8-7.7L/h)(全血浓度)和150.1L/h(67.5-265L/h)(血浆浓度)。本品的血浆半衰期从3.5h-40.5h,有的高达50h。肝移植患者全血半衰期平均为11.7h(平均6.
1-20.9h),血浆半衰期为6.7h(2.7-13.3h)。肾清除率小于lml/min,本品主要经胆道清除。代谢和生物转换本品经肝脏代谢,口服或静脉给药后少于l%的本品原型出现在尿中。这表明该药在消除之前几乎完全被代谢。
本品和细胞色素P450 3A系统亲和力高。该药是P450 1A和3A的强效抑制剂。动物和人体肝细胞体外实验显示至少能观察到9种代谢产物,它们是否具有药理学活性还不得而知。有证据表明本品也经肠道代谢。
本品肝代谢的一级反应可能包括单一去甲基、双去甲基、羟化,以及单去甲基和羟化。临床前及临床资料表明,该药能透过胎盘。临床前兔身上的试验表明,本品分泌进乳汁。病人的药动学特性血浆/全血浓度和治疗效果之间的关系如前所述,通过监控全血中本品水平来调整个体用药剂量,以实现最佳治疗效果。
有几种方法可测量全血中本品浓度,这包括全自动微粒酵素免疫定量分析法(MEIA),详细资料备索。因年龄、多形态现象、代谢作用及合并其他病理情况(肾衰、肝功能不全)所致之变异性有限的经验表明,老年患者的药动学性质不变。
儿童患者需要的剂量较高,为成人剂量的1.5-2倍,可能是因为他们有较高的代谢转换率.肝功能不全的患者肝功能不全的患者较肝功能正常的患者有较高的血药浓度(相对较长的半衰期和较低的清除率)。
因本药物广泛被肝脏代谢,肝功能不全患者需仔细监测全血浓度,并需调整使用剂量。肾衰的患者本药几乎完全代谢,脂溶性高且分子量为822,可预计无法用透析排除。
此外给予单一剂量静注后,进入尿里的药物小于1%,因此从药代动力学观点来看,肾衰病人或肾透析的患者并不需要调整剂量。但如果是本药引起的肾功能异常,则需调整剂量。
预防肝脏或肾脏移植术后的移植物排斥反应。治疗肝脏或肾脏移植术后应用其他免疫抑制药物无法控制的移植物排斥反应。