王宇明谈乙肝 王宇明:探寻适合我国的慢乙肝优化治疗
2005年版《慢性乙型肝炎防治指南》(简称《指南》)与2010年版《指南》的一个显著差异,是关于慢性乙型肝炎(CHB)的治疗目标。
前者提出最大限度地长期抑制或消除HBV,减轻肝细胞炎症坏死及肝纤维化,延缓和阻止疾病进展,减少和防止肝脏失代偿、肝硬化、肝细胞癌(HCC)及其并发症的发生,从而改善生活质量和延长生存时间;而后者删去了"消除HBV"的提法。
记得在2005年版《指南》起草过程中还在讨论究竟用"清除(eradication)"还是"消除(elimination)"的表述,而现在较为保守的"消除"也删掉了,可见专业学术界对关于CHB抗病毒治疗疗程的看法更加趋于延长。
国外批准用于CHB抗病毒治疗的药物有干扰素α (IFNα)类如重组IFNα、聚乙二醇干扰素α(Peg-IFNα),核苷类似物(NUCs)类如拉米夫定(LAM)、阿德福韦酯(ADV)、恩替卡韦(ETV)、替比夫定(LdT)、替诺福韦(TDF)。
然而,后者虽然已在中国上市,但尚未获得CHB的适应证。
因此,目前抗HBV治疗的药物种类还较有限,如何更好地使用这些药物发挥最大的疗效是值得深入研究的问题[3-4]。优化治疗策略对解决这个问题迈出了重要的一步,从而成为CHB治疗的主要策略。
一、什么是优化治疗?其意义如何? 众所周知,优化治疗是临床治疗学的精髓,是放之四海而皆准的准则,是古今中外中西医的共同出发点,多种提法如自古以来中医的辨证施治、现代临床医学的个体化治疗、应答指导下的治疗(response guided therapy, RGT)均反映了优化治疗的思想。
反之,一成不变的治疗方法则已被公认为不科学的方法。据多年来研究,优化治疗不仅适用于CHB抗病毒治疗,也适用于多种疾病的治疗,如艾滋病、结核病、糖尿病、脑神经胶质瘤及帕金森病等。
查阅近年文献,在各种疾病中相比之下,优化治疗还是CHB及慢性丙型肝炎(CHC)提得最多。
例如,新(《指南》在核苷类似物治疗相关问题中首次明确提到"优化治疗"团。优化治疗的概念就是根据患者的基线状况、早期应答情况对治疗进行适当的调整,以达到提高疗效的目的。优化治疗的问题并不特指某一个药,也不是特指某一类药,实际上已成为整个CHB治疗过程中很重要的治疗策略,成为CHB治疗的一个共性问题。
CHB优化治疗的目的是提高疗效、降低耐药、提高依从性、降低成本。优化治疗一个很重要的理论根据,就是患者治疗前的状态(基线状况)与治疗疗效相关,治疗一段时间之后的应答情况与长期治疗的疗效相关,因此,临床上根据基线状态和早期治疗的应答来对治疗方案进行调整,以提高疗效,这样的治疗就是优化治疗。
新《指南》指出,有临床研究显示,因对某- NUCs发生耐药而先后改用其他NUCs治疗,可筛选出对多种NUCs耐药的变异株。
因此,应避免单药序贯治疗。为此,在绝大多数的NUCs中序贯治疗不再作为优化治疗的选择。 回顾历史,学术界对CHB的认识可分为三个时代:①病理学时代早期(20世纪80年代以前):分成慢性迁延性肝炎(CPH)及慢性活动性肝炎(CAH);②病理学时代后期(20世纪80~90年代末):摒弃了CPH和CAH分类,将CHB分成慢性肝炎轻度、中度及重度;③病原学时代(20世纪90年代末至今):将CHB分成HBeAg阳性与HBeAg阴性。
总体趋势是从病理学分型发展到病原学分型。其原因和意义在于病因学治疗日益重要,这是因为HBeAg阳性与阴性患者用药选择、疗程等均有差异。这也是CHB优化治疗最早依据。
二、优化治疗有何证据? 优化治疗最早是根据LdT治疗CHB全球的临床试验结果提出来的,这个临床试验设计为2年时间,研究发现在治疗24周时,患者应答的情况与2年的疗效相关,如治疗24周时病毒下降到不可测水平,2年的疗效较佳,即病毒的控制很好、HBeAg血清转换率比较高、耐药发生率比较低。
因此,早期疗效对于判断后续的治疗方法是否需要调整是有帮助的。此外,患者治疗前的基线状况,病毒载量和ALT的水平也与长期治疗疗效相关。 各种NUCs治疗24周时HBV DNA可检出率,HBeAg阳性患者为:LdT 55%、ETV 51%、LAM68%、ADV 88%;HBeAg阴性患者为:LdT 20%、ETV 20%、LAM 29%、ADV 64%。
相比之下,ADV偏高,提示其抑制病毒的强度、幅度均偏低。LAM和LdT 24周病毒学应答不佳者,104周HBVDNA阴转率低;ETV 24周病毒学应答欠佳者,52周HBV DNA检测不到率低。
LAM和LdT 24周病毒学应答欠佳者,48周耐药率增加。ADV 48周应答欠佳者,3年耐药率增加[12-13]。上述结果提示,及早(如24周内)充分抑制病毒到不可测水平是必要的。
GLOBE研究发现,24周HBV DNA检测不到是HBeAg阳性患者104周疗效的最强预测因子。NUCs治疗,24周强病毒抑制与52周较高PCR检测不到率相关。
LAM治疗基线特征结合24周应答可预测5年疗效。基线HBeAg水平可预测24周及52周时HBV DNA检测不到率,如24周HBeAg水平< 10 PEIU/ml,52周HBeAg血清学转换率更高。
HBsAg在24/52周的快速下降预示着更高的3年时HBsAg转阴率‘161。由此可见,对CHB抗病毒治疗的策略进行优化很有必要,国内外大多数学者观点及指南均强调了优化治疗的必要性和重要性。
为此,已故著名肝病学者Keeffe提出了CHB治疗路线图的概念,即根据24周时HBV DNA水平预测远期的疗效,调整治疗方案。
按照该路线图,开始治疗后,在第12周应对患者的病毒应答进行初次评估,如HBV DNA下降<1 109io拷贝/ml,则定义为原发治疗失败或无应答,如果并非依从性不佳所致,即应改变治疗方案。
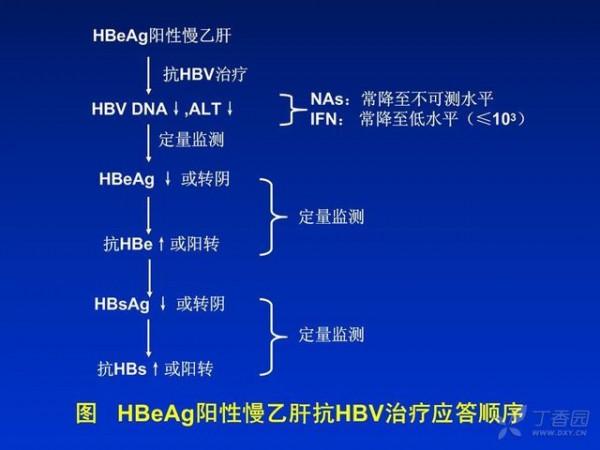
24周则被公认为另一个非常重要的时间点,根椐治疗24周时的应答,可将患者分为完全病毒学应答、部分病毒学应答或不充分的病毒学应答。即:①完全病毒学应答是指HBVDNA<300拷贝/ml,产生完全应答的患者应在医生的指导下继续服用同一种药物治疗,随访间隔可延长至6个月,但由于我国病毒定量系采用实时荧光定量而非COBAS定量方法,精确度不够高,故最好还是每3个月检测1次。
②部分病毒学应答是指第24周时HBV DNA水平2 0且<104拷贝/ml,应考虑加用1种无交叉耐药的药物,但也可考虑暂不改变方案,密切随访(每3个月随访1次),服药时间持续到48周;如果48周时仍是部分应答或转为不充分应答,应更换治疗方案;如果48周时变成完全应答,则继续原方案治疗。
③不充分的病毒学应答是指第24周时HBV DNA水平三l04拷贝/ml,此类患者应调整治疗方案,并应每3个月复查1次,治疗48周以上应根据检测结果确定复查间隔时间,如HBV DNA降到PCR检测不到水平,则可将复查间隔时间从3个月延至6个月,但对于有肝硬化特别是失代偿风险的患者,无论病毒学应答情况如何,均应每隔3个月复查1次。
建立CHB治疗路线图的意义在于治疗过程中监测早期病毒学应答,有助于识别应答不佳者,提供时机调整治疗方案,以提高抗病毒疗效,有助于实现个体化治疗,改善长期预后。 三、优化治疗,还是联合治疗? 实际上,所谓"优化治疗,还是联合治疗好?"的命题是不存在的。
其理由在于,从来就没有任何指南或共识将"优化治疗"定义为单药治疗。为此,"优化治疗"可理解为对患者最为/较为恰当的治疗,而"最佳治疗"则只考虑最佳疗效而不考虑实际经济条件及性价比[18-19]。
因此,选择"优化治疗"方案的依据是"临床疗效 安全性 经济性"。 医患常常有一个问题:优化治疗与初始联合治疗哪个更好?众所周知,进行抗病毒治疗时应注意三个方面(即所谓"三点"):①起点:严格掌握治疗适应证,选用适当药物,以提高应答率;②拐点:即早期病毒学应答的监测时间,可通过应答情况预测病毒学应答率及耐药率等,从而调整治疗方案;③终点:即通过治疗所要达到的目标。
优化治疗就是在原来的基础上重视上述"三点",达到高疗效、低耐药的目的。联合治疗也是为了提高疗效和减少耐药,临床实践证明,联合治疗具有高疗效、低耐药的特点,特别是目前常用的LAM十ADV,但联合用药价格不菲。
这样,在实际抗病毒治疗过程中,医生不仅要考虑其安全性、临床疗效及耐药率,更要考虑患者的依从性,而在依从性中经济负担为重要因素,往往有部分人因经济负担而放弃治疗。
作为现阶段的治疗方案,优化治疗与联合治疗也缺乏大量的临床对比研究。因此,在临床实际中,由个人的具体情况,根据上述"临床疗效 安全性 经济性"综合因素考虑选择最佳治疗方案。
由于每个患者的病毒特性、机体应答、药物反应及经济条件各不相同,这就要求治疗的个体化,具体情况具体分析。这就像打仗一样,通过战略与战术的调整,才能获得最佳战绩。 四、初始联合(de novo)治疗有无必要?适用于哪些情况? 初始联合的提出,系因迄今在抗HBV治疗中耐药是普遍存在及难以避免的。
主要发现有:①CHB患者普遍存在预存耐药株,它们是天然存在的;②所有NUCs均存在耐药现象,其间可有交叉耐药;③采用单药治疗耐药后序贯另一NUCs的耐药率高,故当前各国指南已摒弃了序贯单药治疗方案;④采用单药优化治疗的方法(即耐药后加药),也不能预防最后的交叉耐药。
这些发现均提示,选用无交叉耐药的NUCs或IFNⅨ类与NUCs联合,可能通过加强病毒抑制及降低耐药发生,从而提高疗效。
我们曾提出,初始联合治疗的主要适应证有:①有耐药史包括可疑耐药者;②耐药史不详但有可能耐药者;③有耐药风险的高危人群,如高病毒载量等在耐药后可能发生炎症加重或突破,对病情不利,且难以监测者;④已发生序贯耐药者;⑤具备上述情形之一且不适合IFN治疗者。
应当指出,对于初始联合治疗尚未取得完全一致的意见,而造成意见不同的因素包括:①初始联合治疗费用较高,对于单药治疗有效的部分患者是一种浪费;②安全性证据尚不充分,有的联合方案因严重不良事件(SAE)出现而遭到否定,如Peg-IFNα加LdT可致外周神经肌肉疾病;③有效性循证医学证据尚不充分;④初步结果证明耐药性有明显降低,但未能完全避免,其结果是交叉耐药的发生。
有学者提出,如联合治疗成为主流核心策略,治疗费用将极大幅/成倍攀升,长期乃至终生治疗的实施将成为巨大挑战。不良反应可能增加,交叉耐药发生后将面临困境,患者心理压力加大。
所谓"大包围"即形象地批判了盲目进行联合治疗的做法。 虽然存在以上争议,但临床上应用LAM ADV的初始联合治疗有逐渐增多趋势,其原因是:①经临床应用证明,二者联合有效性和安全性均较为良好;②无论进口或国产制剂价格均较合理,至少与ETV单药治疗比较也是如此;③交叉耐药的问题则并非其主要问题,因与单药治疗相比,待耐药以后加药治疗相比,初始联合治疗的交叉耐药只会更低。
五、优化治疗有哪些成功经验? 首先应当承认,有关优化治疗的成功经验尚不多见,以下原因可能与之相关:①虽然IFNⅨ类已应用较长时间,但早期阶段品种单一,加之当时我国制剂不够过关,临床经验缺乏;而Peg-IFNα价格昂贵,疗效提高有限;②NUCs问世较短,LAM单一品种占据了5年余,以后才逐渐出现ADV、ETV、LdT及TDF等,从而限制了相关经验的积累及发展;③在联合治疗方面,早期阶段主要集中在LAM Peg-IFNα,且不够成功,2005年以后才开始有关NUCs之间及其与Peg-IFN α的联合治疗,迄今系统研究尚不多见。
如前所述,虽然资料有限,但发展迅速。迄今的有关经验表明:(1)单药治疗可以优化:最主要的经验有三:一是优化适应证,如同田忌赛马,可从起点上预测结果;二是治疗早期的调整,目前倾向于更积极的调整,如将过去1×10^4拷贝/ml改成1×10^3拷贝/ml等,形成阵地前移,以防患于未然的态势;三是通过HBV血清标志物(HBV M)如HBeAg、抗- HBe、HBsAg等的半定量/定量或高精度病毒定量(如COBAS Amplicor)进行监测,预测结果,把握时机,争取最佳治疗结局;同时,更准确地掌握停药时机,减少因判断不准(如酶联免疫吸附法所致HBVM结果误差)而导致误判,从而使停药后反弹/复发降低;最后,经过大量循证医学证据证明,使用NUCs长期(如3年以上)未发生耐药者,继续使用很少发生耐药,现特将其称为"稳态现象",提示对这些患者不必采用升阶梯治疗,更换成更为强效和低耐药药物,以减少开支。
(2)联合治疗也可以优化:除了单药治疗中的早期调整即加药外,初始联合也逐渐成为CHB的选择之一。
此部分的经验主要有:①适应证选择是获得良好疗效的关键,失之过宽不仅浪费,而且一旦耐药往往形成交叉耐药,从而使后续选择减少,失之过严则在某些人群造成更多耐药,加药后也是如此;②已经明确某些联合有一定前景,如LAM或LdT联合ADV、ADV联合IFNα类等;另一方面,某些联合则可出现明显不良反应(如LdT联合IFN仅类),或从理论不符合联合原则(如LAM联合LdT、ADV联合TDF、ETV LAM或ETV LdT等)。
六、总结及展望 按照欧洲肝病研究学会2007年指南,CHB治疗终点有三:HBV DNA检测不到是"基本的治疗终点";HBeAg血清学转换是"满意的治疗终点";HBsAg消失或血清转换是"理想的治疗终点"。
即使患者接受了规范的抗病毒治疗,仍然会有部分患者达不到 理想的治疗应答,更难以到达"理想终点"。现有的抗病毒药物治疗后,仍有相当比例的患者早期应答不佳,早期疗效欠佳者,远期应答率低,且耐药率增加,这会导致疗程延长和费用增加,降低患者依从性。
因此,需要进一步通过优化治疗提高疗效。 优化治疗的运用原则为:①起点:选用适当药物;②拐点:及时调整方案;③终点:把握停药时机及随访。
优化治疗对提高口服抗病毒药物疗效、降低耐药具有重要意义,如基线/早期病毒学应答可预测远期疗效,HBV DNA监测是口服抗病毒药物治疗时的重要监测,可根据早期HBV DNA抑制情况来调整治疗方案,以减少耐药。
更多的疗效预测研究正在进行中,如早期HBeAg及HBsAg定量预测远期应答及预测口服抗病毒药物的停药时间。
优化治疗与联合治疗的关系为:①优化治疗是纲,联合治疗是目,纲举目张;②多数CHB治疗应选用单药优化治疗原则,而少数CHB治疗应选用联合优化治疗原则;③单药优化治疗应为主流治疗方法,而联合优化治疗应为主要补充治疗策略。
迄今,LAM与ADV联合的经验最多,而随着TDF等NUCs的出现或应用增多,其他联合治疗方法会逐渐增加。
虽然单药优化治疗原则仍适用于绝大多数患者,但总体趋势是逐渐减少。
随着初治患者减少,联合优化治疗可能相对增多。 总之,优化治疗是各种疾病包括CHB的核心治疗策略;优化治疗策略贯穿CHB治疗全过程,包括起点、拐点及终点,目的是提高疗效、降低耐药、提高依从性、降低成本;优化治疗策略包括单药优化及联合优化,二者相辅相成,互相补充;单药优化及联合优化的经验日益增多,目前以LAM/ADV最为突出;今后NUCs之间的联合基本原则仍是核苷类似物 核苷酸类似物。



















![>王宇明江一凡 南通民俗专家王宇明谈过年之一:除夕习俗[组图]](https://pic.bilezu.com/upload/3/66/36692f385a5a4486d4050c16a018a54d_thumb.jpg)





