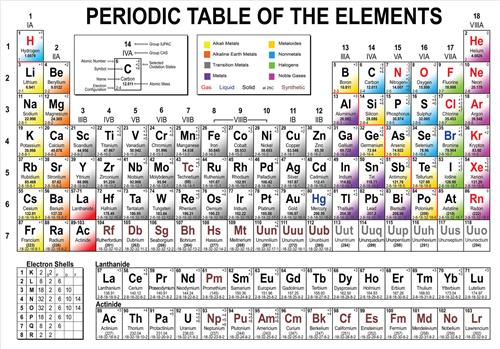
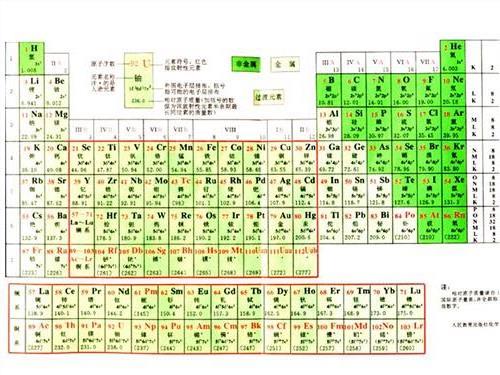
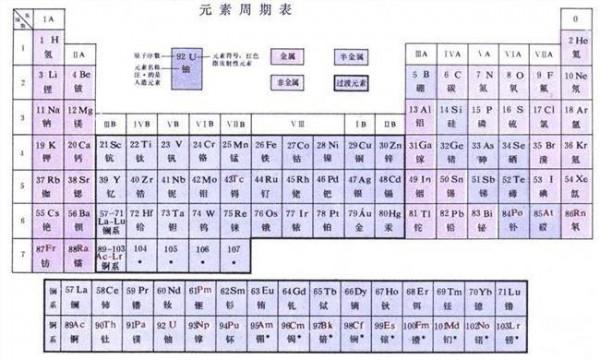
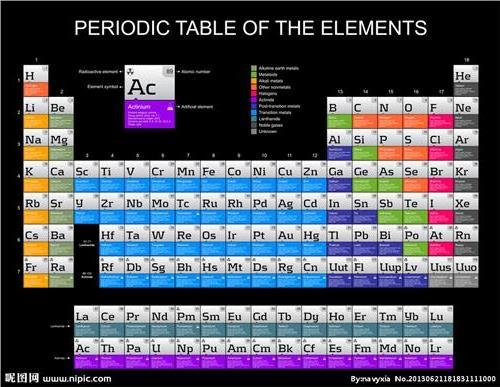
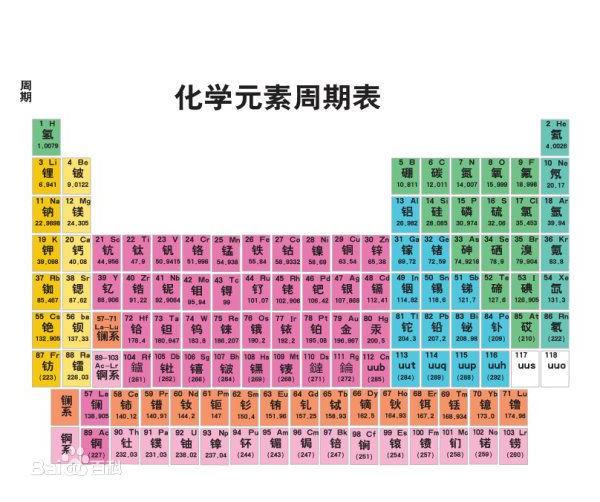
【如何根据化学元素周期表的规律判断熔沸点的高低?高中生……o(∩
为了解决用户可能碰到关于"如何根据化学元素周期表的规律判断熔沸点的高低?高中生……O(∩_∩)O谢谢!"相关的问题,突袭网经过收集整理为用户提供相关的解决办法,请注意,解决办法仅供参考,不代表本网同意其意见,如有任何问题请与本网联系。"如何根据化学元素周期表的规律判断熔沸点的高低?高中生……O(∩_∩)O谢谢!"相关的详细问题如下:RT,我想知道:如何根据化学元素周期表的规律判断熔沸点的高低?高中生……O(∩_∩)O谢谢!===========突袭网收集的解决方案如下===========
解决方案1:首先,判断元素单质的熔沸点要先判断其单质的晶体类型,晶体类型不同,决定其熔沸点的作用也不同。金属的熔沸点由金属键键能大小决定;分子晶体由分子间作用力的大小决定;离子晶体由离子键键能的大小决定;原子晶体由共价键键能的大小决定。所以第一主族的碱金属熔沸点是由金属键键能决定,在所带电荷相同的情况下,原子半径越小,金属键键能越大,所以碱金属的熔沸点递变规律是:从上到下熔沸点依次降低。第七主族的卤素,其单质是分子晶体,故熔沸点由分子间作用力决定,在分子构成相似的情况下,相对分子质量越大,分子间作用力也越大,所以卤素的熔沸点递变规律是:从上到下熔沸点依次升高。用这样的方法去判断同主族元素的熔沸点递变规律就行了,因为理解才是最重要的。
同周期的话,不太好说了。通常会比较同一类型的元素单质熔沸点,比如说比较Na、Mg、Al的熔沸点,则由金属键键能决定,Al所带电荷最多,原子半径最小,所以金属键最强,故熔沸点是:Nalt;Mglt;Al。非金属元素一般不会比较它们单质之间的熔沸点,一般比较他们的氢化物的熔沸点。比较时要注意CH4、NH3、H2O、HF他们的分子间除分子间作用力外,还有氢键,所以同主族氢化物2熔沸点他们是最高的,其余的按分子间作用力大小排列。如氧族元素氢化物的熔沸点是:H2Ogt;H2Tegt;H2Segt;H2S;卤素:HFgt;HIgt;HBrgt;HCl。同周期比较的话,是从左至右熔沸点依次升高,因为气态氢化物的热稳定性是这样递变的。另外有时还要注意物质的类型,比如让你比较金刚石、钙、氯化氢的熔沸点,只要知道金刚石是原子晶体,熔沸点最高,其次是金属钙,最后是分子晶体氯化氢。还有原子晶体的:比较金刚石、晶体硅、碳化硅的熔沸点,那就要看共价键了,原子半径越小,共价键键能越大,故熔沸点:金刚石gt;碳化硅gt;晶体硅。
================可能对您有帮助================
答:首先,判断元素单质的熔沸点要先判断其单质的晶体类型,晶体类型不同,决定其熔沸点的作用也不同。金属的熔沸点由金属键键能大小决定;分子晶体由分子间作用力的大小决定;离子晶体由离子键键能的大小决定;原子晶体由共价键键能的大小决定。 所...
===========================================
答:这不大得行!要根据晶体类型确定。分子晶体相对分子质量越大范得法力越大熔沸点越大
问:元素周期表中各主族熔沸点递变规律,最重要是碳族同氮族单质的熔沸点递...
答:判断物质的晶体类型,主要通过元素之间的化学键来判断,如NaCl,Na第一主族还原性强,Cl第七主族氧化性强形成的键是离子键,所以形成的晶体就是例子晶体;钻石,由C组成第4主族,物明显的氧化还原性,只能以共价键结合,所以是原子晶体;干冰,...
问:如何判断元素周期表中各元素的溶沸点?
答:你是指单质的熔沸点吧? 其实要根据此单质是金属单质还是非金属单质判断。要是金属单质,同族的越向下,金属性越强,熔沸点越低,要是非金属单质要看形成晶体的类型,要是分子晶体,那么同族越向下,单质式量越大,分子间作用力越大,熔沸点越高。
答:单质的熔点 (1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减; (2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增
答:周期中部的单质熔沸点较高。
问:要详细推理过程和结论 帮个忙,谢谢
答:比较熔沸点呢是有点难,你要了解多一点关于晶体的知识,不同的晶体类型比较方法不同 1.金属晶体 金属的化学键是金属键,金属键影响金属熔沸点高低,比如锂的熔点比钠高,就是锂的金属键键长比钠短,键能大,故熔沸点高,从锂到铯,熔沸点依次降...
高中化学里的元素周期表中同一主族的元素的熔沸点...
问:谁能详细解释一下方法啊?谢谢拉!!!!!!!!!
答:通常来说,金属元素比如第一主族,越往下原子半径越大,熔沸点越低,到了卤族元素,就是从上往下越来越高。在分子晶体里,一般遵循着“结构类似的物质,相对分子质量越大其熔沸点越高”。
问:元素熔沸点的递变规律,每一周期的和每一纵列的,我还要金属与非金属的差别
答:随原子序数增大同一周期同一主族 也就是元素周期表中每个元素的头顶的数字 越大的熔沸点就越高 这个只限于金属元素 然而非金属元素 就是要看压强、体积、和空间原子数等因数判断他的熔沸点 非金属的熔沸点是 大学的东西 你们现在用不着的