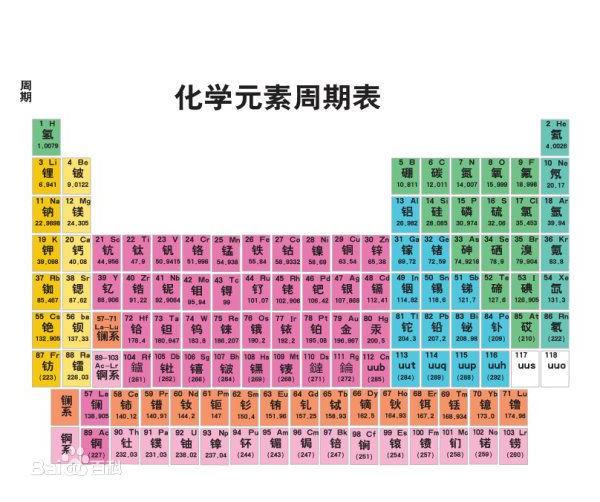
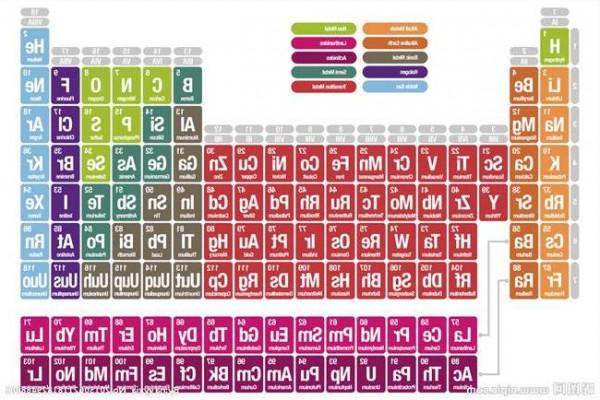
【元素周期表】化学元素周期表解读 元素周期发展历史
化学元素周期表是根据原子序数从小至大排序的化学元素列表。列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如卤素、碱金属元素、稀有气体(惰性气体或贵族气体)、放射性元素等。
这使周期表中形成元素分区且分有七主族、七副族与零族、八族。由于周期表能够准确地预测各种元素的特性及其之间的关系,因此它在化学及其他科学范畴中被广泛使用,作为分析化学行为时十分有用的框架。
俄国化学家门捷列夫于1869年发明周期表,此后不断有人提出各种类型周期表不下170余种,归纳起来主要有:短式表(以门捷列夫为代表)、长式表(维尔纳式为代表)、特长表(以波尔塔式为代表)。平面螺线表和圆形表(以达姆开夫式为代表)。立体周期表(以莱西的圆锥柱立体表为代表)等。小学上长期习用的是长式周期表。
现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依相对原子质量大小并以表的形式排列,把有相似化学性质的元素放在同一列,制成元素周期表的雏形。
经过多年修订后才成为当代的周期表。在周期表中,元素是以元素的原子序排列,最小的排行最先。表中一横行称为一个周期,一列称为一个族。原子半径由左到右依次减小,上到下依次增大。
在化学教科书和字典中,都附有一张“元素周期表(英文:the periodic table)”。这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。看到这张表,人们便会想到它的最早发明者——门捷列夫。
1869年,俄国化学家门捷列夫按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行,编制出第一张元素周期表。元素周期表揭示了化学元素之间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。
随着科学的发展,元素周期表中未知元素留下的空位先后被填满。当原子结构的奥秘被发现时,编排依据由相对原子质量改为原子的质子数﹙核外电子数或核电荷数﹚,形成现行的元素周期表。
按照元素在周期表中的顺序给元素编号,得到原子序数。原子序数跟元素的原子结构有如下关系:质子数=原子序数=核外电子数=核电荷数
利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序)排列。后来又经过多名科学家多年的修订才形成当代的周期表。
元素周期表中共有118种元素。将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列。每一种元素都有一个序号,大小恰好等于该元素原子的核内质子数,这个序号称为原子序数。在周期表中,元素是以元素的原子序排列,最小的排行最前。表中一横行称为一个周期,一列称为一个族(8、9、10纵行为一个族)。
原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。
元素周期表有7个周期,16个族。每一个横行叫作一个周期,每一个纵行叫作一个族。这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)。共有16个族,又分为7个主族(ⅠAⅡA ⅢA ⅣA ⅤA ⅥA ⅦA), 7个副族(ⅠB ⅡB ⅢB ⅣB ⅤB ⅥB ⅦB),一个第Ⅷ族(包括三个纵行),一个零族。
元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。使其构成了一个完整的体系称为化学发展的重要里程碑之一。
同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子序数递增,元素金属性递增,非金属性递减。
元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物。
导读:表格说明 周期表化学元素周期表图集张的编排显示出不同元素的化学性质的周期性,在周期表中,元素按原子序即原子核内的质子数目)递增次序排列,并分为若干列和栏,在同一行中的称为同一周期,根据量子力学,周期对应着元素原子关键词:
表格说明周期表化学元素周期表图集(20张)的编排显示出不同元素的化学性质的周期性,在周期表中,元素按原子序(即原子核内的质子数目)递增次序排列,并分为若干列和栏,在同一行中的称为同一周期,根据量子力学,周期对应着元素原子的电子排布,显示出该原子的已装填电子层数目。沿着周期表向下,周期的长度逐渐上升,并按元素的电子排布划分出s区元素、p区元素、d区元素和f区元素。
而同一栏中的则称为同一族,同一族的元素有着相似的化学性质。 在印刷的周期表中,会列出元素的符号和原子序数。而很多亦会附有以下的资料,以元素X为例:
A:质量数 (Mass number) ,即在数量上等于原子核(质子加中子)的粒子数目。
Z:原子序数,即是质子的数目。由于它是固定的,一般不会标示出来。 e:净电荷,正负号写在数字后面。 n:原子数目,元素在非单原子状态(分子或化合物)时的数目。 除此之外,部份较高级的周期表更会列出元素的电子排布、电负性和价电子数目。
元素读音
第一周期元素:1 氢(qīng) 2 氦(hài) 元素周期表正确金属汉字写法
第二周期元素:3 锂(lǐ) 4 铍(pí) 5 硼(péng) 6 碳(tàn) 7 氮(dàn) 8 氧(yǎng) 9 氟(fú) 10 氖(nǎi) 第三周期元素:11 钠(nà) 12 镁(měi) 13 铝(lǚ) 14 硅(guī) 15 磷(lín) 16 硫(liú) 17 氯(lǜ) 18 氩(yà) 第四周期元素:19 钾(jiǎ) 20 钙(gài) 21 钪(kàng) 22 钛(tài) 23 钒(fán) 24 铬(gè) 25 锰(měng) 26 铁(tiě) 27 钴(gǔ) 28 镍(niè) 29 铜(tóng) 30 锌(xīn) 31 镓(jiā) 32 锗(zhě) 33 砷(shēn) 34 硒(xī) 35 溴(xiù) 36 氪(kè) 第五周期元素:37 铷(rú) 38 锶(sī) 39 钇(yǐ) 40 锆(gào) 41 铌(ní) 42 钼(mù) 43 锝(dé) 44 钌(liǎo) 45 铑(lǎo) 46 钯(bǎ) 47 银(yín) 48 镉(gé) 49 铟(yīn) 50 锡(xī) 51 锑(tī) 52 碲(dì) 53 碘(diǎn) 54 氙(xiān) 第六周期元素:55 铯(sè) 56 钡(bèi) 57 镧(lán) 58 铈(shì) 59 镨(pǔ) 60 钕(nǚ) 61 钷(pǒ) 62 钐(shān) 63 铕(yǒu) 64 钆(gá) 65 铽(tè) 66 镝(dī) 67 钬(huǒ) 68 铒(ěr) 69 铥(diū) 70 镱(yì) 71 镥(lǔ) 72 铪(hā) 73 钽(tǎn) 74 钨(wū) 75 铼(lái) 76 锇(é) 77 铱(yī) 78 铂(bó) 79 金(jīn) 80 汞(gǒng) 81 铊(tā) 82 铅(qiān) 83 铋(bì) 84 钋(pō) 85 砹(ài) 86 氡(dōng) 第七周期元素:87 钫(fāng) 88 镭(léi) 89 锕(ā) 90 钍(tǔ) 91 镤(pú) 92 铀(yóu) 93 镎(ná) 94 钚(bù) 95 镅(méi) 96 锔(jú) 97 锫(péi) 98 锎(kāi) 99 锿(āi) 100 镄(fèi) 101 钔(mén) 102 锘(nuò) 103 铹(láo) 104 鈩(lú) 105 (dù) 106 (xǐ) 107 (bō) 108 (hēi) 109 (mài) 110 鐽(dá) 111 錀(lún) 112 鎶(gē)[暂定] 注:新元素汉字请使用Win7系统浏览,XP系统下无法显示。
104-10
9金属元素字符XP系统下拼凑显示为 钅卢(lú) 钅杜 (dù) 钅喜(xǐ) 钅波 (bō )钅黑(hēi) 钅麦(mài) 。
元素的外层电子壳层结构
外围电子层排布,元素附注为元素的电子壳层结构的电子组态(最外层电子的基态以及数量),s 、p、d、f 标记轨道角动量在 z 轴方向上投影的磁量子数。例如 1s1,前面的1表示壳层数,s表示轨道量子数为0的量子态(基态的简并态之一),后面的1表示最外层电子的数目(是电子自旋态以及pauli原理决定的)。
详情请参考量子力学。
1 H 1s1 2 He 1s2 3 Li 2s1 4 Be 2s2 5 B 2s2 2p1 6 C 2s2 2p2 7 N 2s2 2p3 8 O2s2 2p4 9 F 2s2 2p5 10 Ne 2s2 2p6 11 Na 3s1 12 Mg 3s2 13 Al 3s2 3p1 14 Si 3s2 3p2 15 P 3s2 3p3 16 S 3s2 3p4 17 Cl 3s2 3p5 18 Ar 3s2 3p6 19 K 4s1 20 Ca 4s2 21 Sc 3d1 4s2 22 Ti 3d2 4s2 23 V 3d3 4s2 24 Cr 3d5 4s1 25 Mn 3d5 4s2 26 Fe 3d6 4s2 27 Co 3d7 4s2 28 Ni 3d8 4s2 29 Cu 3d10 4s1 30 Zn 3d10 4s2 31 Ga 4s2 4p1 32 Ge 4s2 4p2 33 As 4s2 4p3 34 Se 4s2 4p4 35 Br 4s2 4p5 36 Kr 4s2 4p6 37 Rb 5s1 38 Sr 5s2 39 Y 4d1 5s2 40 Zr 4d2 5s2 41 Nb 4d4 5s1 42 Mo 4d5 5s1 43 Tc 4d5 5s2 44 Ru 4d7 5s1 45 Rh 4d8 5s1 46 Pd 4d10 47 Ag 4d10 5s1 48 Cd 4d10 5s2 49 In 5s2 5p1 50 Sn 5s2 5p2 51 Sb 5s2 5p3 52 Te 5s2 5p4 53 I 5s2 5p5 54 Xe 5s2 5p6 55 Cs 6s1 56 Ba 6s2 57 La 5d1 6s2 58 Ce 4f1 5d1 6s2 59 Pr 4f3 6s2 60 Nd 4f4 6s2 61 Pm 4f5 6s2 62 Sm 4f6 6s2 63 Eu 4f7 6s2 64 Gd 4f7 5d1 6s2 65 Tb 4f9 6s2 66 Dy 4f10 6s2 67 Ho 4f11 6s2 68 Er 4f12 6s2 69 Tm 4f13 6s2 70 Yb 4f14 6s2 71 Lu 4f14 5d1 6s2 72 Hf 5d2 6s2 73 Ta 5d3 6s2 74 W 5d4 6s2 75 Re 5d5 6s2 76 Os 5d6 6s2 77 Ir 5d7 6s2 78 Pt 5d9 6s1 79 Au 5d10 6s1 80 Hg 5d10 6s2 81 Tl 6s2 6p1 82 Pb 6s2 6p2 83 Bi 6s2 6p3 84 Po 6s2 6p4 85 At 6s2 6p5 86 Rn 6s2 6p6 87 Fr 7s1 88 Ra 7s2 89 Ac 6d1 7s2 90 Th 6d2 7s2 91 Pa 5f2 6d1 7s2 92 U 5f3 6d1 7s2 93 Np 5f4 6d1 7s2 94 Pu 5f6 7s2 95 Am 5f7 7s2 96 Cm 5f7 6d1 7s2 97 Bk 5f9 7s2 98 Cf 5f10 7s2 99 Es 5f11 7s2 100 Fm 5f12 7s2 101 Md (5f13 7s2) 102 No (5f14 7s2) 103 Lr (5f14 6d17s2) 104 Rf (6d2 7s2) 105 Db (6d3 7s2) 106 Sg 5f146d47s2 107 Bh 5f146d57s2 108 Hs 5f146d67s2 109 Mt 5f146d77s2 110 Ds 5f146d97s1 111 Rg 5f146d107s1 112 Cn 5f146d107s2 113 Uut 5f146d107s27p1 114 Uuq 5f146d107s27p2 115 Uup 5f146d107s27p3 116 Uuh 5f146d107s27p4 117 Uus 5f146d107s27p5 118 Uuo 5f146d107s27p6
编辑本段递进循环
1 原子半径
(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小; (2)同一族的元素从上到下,随电子层数增多,原子半径增大。
注意:原子半径在IVB族及此后各副族元素中出现反常现象。从钛至锆,其原子半径合乎规律地增加,这主要是增加电子层数造成的。然而从锆至铪,尽管也增加了一个电子层,但半径反而减小了,这是与它们对应的前一族元素是钇至镧,原子半径也合乎规律地增加(电子层数增加)。
然而从镧至铪中间却经历了镧系的十四个元素,由于电子层数没有改变,随着有效核电荷数略有增加,原子半径依次收缩,这种现象称为“镧系收缩”。镧系收缩的结果抵消了从锆至铪由于电子层数增加到来的原子半径应当增加的影响,出现了铪的原子半径反而比锆小的“反常”现象。
2元素变化规律
(1) 除第一周期外,其余每个周期都是以金属元素开始逐渐过渡到非金属元素,最后以稀有气体元素结束。
(2)每一族的元素的化学性质相似
3元素化合价
(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外),皆呈阶梯式变化。 (2)同一主族的元素的最高正价、负价均相同 。 (3) 所有单质都显零价。
4单质的熔点
(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减; (2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。
5元素的金属性与非金属性
(1)同一周期的元素电子层数相同。因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增; (2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。
6最高价氧化物和水化物的酸碱性
元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
7 非金属气态氢化物
元素非金属性越强,气态氢化物越稳定。同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。
8单质的氧化性、还原性
一般元素的金属性越强,其单质的还原性越强,其氧化物的阳离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
编辑本段元素周期律
概述
元素周期表是元素周期律用表格表达的具体形式,它反映元素原子的内部结构和它们之间相互联系的规律。元素周期表简称周期表。元素周期表[1]有很多种表达形式,目前最常用的是维尔纳长式周期表。元素周期表有7个周期,有16个族和4个区。元素在周期表中的位置能反映该元素的原子结构。周期表中同一横列元素构成一个周期。同周期元素原子的电子层数等于该周期的序数。
同一纵行(第Ⅷ族包括3个纵行)的元素称“族”。族是原子内部外电子层构型的反映。例如外电子构型,IA族是ns1,IIIA族是ns2 np1,O族是ns2 np4, IIIB族是(n-1) d1·ns2等。元素周期表能形象地体现元素周期律。
根据元素周期表可以推测各种元素的原子结构以及元素及其化合物性质的递变规律。当年,门捷列夫根据元素周期表中未知元素的周围元素和化合物的性质,经过综合推测,成功地预言未知元素及其化合物的性质。现在科学家利用元素周期表,指导寻找制取半导体、催化剂、化学农药、新型材料的元素及化合物。
现代化学的元素周期律是1869年俄国科学家德米特里·伊万诺维奇·门捷列夫(Dmitri Ivanovich Mendeleev )首先整理,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,就是元素周期表的雏形。
利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序数越大,X射线的频率就越长,因此他认为原子核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序数)排列,经过多年修订后才成为当代的周期表。
当然还有未知元素等待我们探索. 这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。
位置规律
判断元素在周期表中位置应牢记的规律: (1)元素周期数等于核外电子层数; (2)主族元素的族数等于最外层电子数。 阴阳离子的半径大小辨别规律 由于阴离子是电子最外层得到了电子 而阳离子是失去了电子 所以, 总的来说(同种元素) (1) 阳离子半径原子半径 (2) 阴离子半径原子半径 (3) 阴离子半径阳离子半径 (4)对于具有相同核外电子排布的离子,原子序数越大,其离子半径越小。
(不适合用于稀有气体)
编辑本段作用意义
1869年,门捷列夫发现了元素周期律和元素周期表,在元素周期律的指导下,利用元素之间的一些规律性知识来分类学习物质的性质,就使化学学习和研究变得有规律可循。
现在,化学家们已经能利用各种先进的仪器和分析技术对化学世界进行微观的探索,并正在探索利用纳米技术制造出具有特定功能的产品,使化学在材料、能源、环境和生命科学等研究上发挥越来越重要的作用。
发展历史
元素周期律的发现是许多科学家共同努力的结果: 1789年,安托万-洛朗·拉瓦锡出版的《化学大纲》中发表了人类历史上第一张《元素表》,在该表中,他将当时已知的23种元素分四类。 1829年,德贝莱纳在对当时已知的54种元素进行了系统的分析研究之后,提出了元素的三元素组规则。他发现了几组元素,每组都有三个化学性质相似的成员。
并且,在每组中,居中的元素的原子量,近似于两端元素原子量的平均值。 1850年,德国人培顿科弗宣布,性质相似的元素并不一定只有三个;性质相似的元素的原子量之差往往为8或8的倍数。 1862年,法国化学家尚古多创建了《螺旋图》,他创造性地将当时的62种元素,按各元素原子量的大小为序,标志着绕着圆柱一升的螺旋线上。他意外地发现,化学性质相似的元素,都出现在同一条母线上。
1863年,英国化学家欧德林发表了《原子量和元素符号表》,共列出49个元素,并留有9个空位。 上述各位科学家以及他们所做的研究,在一定程度上只能说是一个前期的准备,但是这些准备工作是不可缺少的。而俄国化学家门捷列夫、德国化学家迈尔和英国化学家纽兰兹在元素周期律的发现过程中起了决定性的作用。
1865年,纽兰兹正在独立地进行化学元素的分类研究,在研究中他发现了一个很有趣的现象。当元素按原子量递增的顺序排列起来时,每隔8个元素,元素的物理性质和化学性质就会重复出现。由此他将各种元素按着原子量递增的顺序排列起来,形成了若干族系的周期。纽兰兹称这一规律为“八音律”。
这一正确的规律的发现非但没有被当时的科学界接受,反而使它的发现者纽兰兹受尽了非难和侮辱。直到后来,当人人已信服了门氏元素周期之后才警醒了,英国皇家学会对以往对纽兰兹不公正的态度进行了纠正。门捷列夫在元素周期的发现中可谓是中流砥柱,不可避免地,他在研究工作中亦接受了包括自己的老师在内的各个方面的不理解和压力。
门捷列夫出生于1834年,俄国西伯利亚的托博尔斯克市,他出生不久,父亲就因双目失明出外就医,失去了得以维持家人生活的教员职位。门捷列夫14岁那年,父亲逝世,接着火灾又吞没了他家中的所有财产,真是祸不单行。1850年,家境困顿的门捷列夫藉着微薄的助学金开始了他的大学生活,后来成了彼得堡大学的教授。
幸运的是,门捷列夫生活在化学界探索元素规律的卓绝时期。当时,各国化学家都在探索已知的几十种元素的内在联系规律。 1865年,英国化学家纽兰兹把当时已知的元素按原子量大小的顺序进行排列,发现无论从哪一个元素算起,每到第八个元素就和第一个元素的性质相近。
这很像音乐上的八度音循环,因此,他干脆把元素的这种周期性叫做“八音律”,并据此画出了标示元素关系的“八音律”表。 显然,纽兰兹已经下意识地摸到了“真理女神”的裙角,差点就揭示元素周期律了。不过,条件限制了他作进一步的探索,因为当时原子量的测定值有错误,而且他也没有考虑到还有尚未发现的元素,只是机械地按当时的原子量大小将元素排列起来,所以他没能揭示出元素之间的内在规律。
可见,任何科学真理的发现,都不会是一帆风顺的,都会受到阻力,有些阻力甚至是人为的。当年,纽兰兹的“八音律”在英国化学学会上受到了嘲弄,主持人以不无讥讽的口吻问道:“你为什么不按元素的字母顺序排列?” 门捷列夫顾不了这么多,他以惊人的洞察力投入了艰苦的探索。
直到1869年,他将当时已知的63种元素的主要性质和原子量,写在一张张小卡片上,进行反复排列比较,才最后发现了元素周期规律,并依此制定了元素周期表。 元素周期表的发现,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。看到这张表,人们便会想到它的最早发明者——门捷列夫。 在新世纪,科学家又将元素周期表与八卦结合起来,使之更科学。
编辑本段学习技巧
化合价
一价氢氯钾钠银,二价氧钙钡镁锌。三铝四硅五价磷,二三铁二四碳,莫丢二三四五氮,铜汞二价最常见,单质零价记心间。
常见原子团化合价口决
负一硝酸氢氧根(硝酸根NO3- ,氢氧根OH-),负二硫酸碳酸根(硫酸根【SO4】2-碳酸根【CO3】2-),还有负三磷酸根(【PO4】3-),只有铵根(NH4+)是正一 记金属活动性顺序表可以按照下面的口诀来记: 钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。
口诀 周期表分行列,7行18列, 行为周期列为族。 周期有七, 三短(1,2,3)三长(4,5,6)一不全(7), 2 8 8 18 18 32 32满 6、7镧锕各15。 族分7主7副1Ⅷ零, 长短为主,长为副。 1到8重复现, 2、3分主副,先主后副。 Ⅷ特8、9、10, Ⅷ、副全金为过渡。
根据一个小故事来背诵
青 海 青海有一个富人叫李皮朋,他整天用煤炭煮鸡蛋供养着佛奶。他女儿那美女去旅桂林,回来却留了绿牙。后来只能嫁给了一个叫康太的反革命。刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,新娘一生气,当时就休克了。 这下不得了,娘家要上告了。铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方。
这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅 ,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊。
在来把这个故事浓缩一下(横列): 第一周期:氢 氦 ---- 青海 第二周期:锂 铍 硼 碳 氮 氧 氟 氖 ---- 李皮朋 碳蛋养佛奶 第三周期:钠 镁 铝 硅 磷 硫 氯 氩 ---- 那美女旅桂林留绿牙(那美女鬼 流露绿牙) 第四周期:钾 钙 钪 钛 钒 铬 锰 ---- 嫁改康太反革命(锰 念meng3) 铁 钴 镍 铜 锌 镓 锗 ---- 铁姑捏痛新嫁者 砷 硒 溴 氪 ---- 生气(硒 念xi1) 休(溴 念xiu4)克 第五周期:铷 锶 钇 锆 铌 ---- 如此(锶 念si1)一告你 钼 锝 钌 ---- 不(钼 念mu4)得了 铑 钯 银 镉 铟 锡 锑 ---- 老把银哥印西堤 碲 碘 氙 ---- 地点仙 第六周期:铯 钡 镧 铪 ----(彩)色贝(壳)蓝(色)河 钽 钨 铼 锇 ---- 但(见)乌(鸦)(引)来鹅 铱 铂 金 汞 铊 铅 ---- 一白巾 供它牵 铋 钋 砹 氡 ---- 必不爱冬(天) 第七周期:钫 镭 锕 ---- 防雷啊!
纵列
氢锂钠钾铷铯钫 请李娜加入私访 (李娜什么时候当皇上啦) 铍镁钙锶钡镭 媲美盖茨被累(呵!想和比尔.盖茨媲美,小心累着) 硼铝镓铟铊 碰女嫁音他 (看来新郎新娘都改名了) 碳硅锗锡铅 探归者西迁 氮磷砷锑铋 蛋临身体闭 氧硫硒碲钋 养牛西蹄扑 氟氯溴碘砹 父女绣点爱 (父女情深啊) 氦氖氩氪氙氡 害耐亚克先动
溶解性口诀
钾钠铵盐溶 (钾盐钠盐铵盐都溶于水和酸) 硝酸盐相同 (硝酸盐同上) 钾钠钙和钡 (氢氧化钾 氢氧化钠 氢氧化钙 氢氧化钡) 溶碱有四种 (上面四种是可溶性的碱) 氯除银亚汞 (盐酸盐除了银亚汞其他都溶) 硫酸除铅钡 (硫酸盐除了铅和钡其他都溶) (请注意,溶解性口诀中,所谓的溶解范围只在初、高中的课本范围内适用,也有一部分钾、钠、铵盐,硝酸盐,氯化物,硫酸盐难溶而不在口诀中,除上述四种碱外,也有其他可溶的氢氧化物。
)
记忆口诀 化合价
一价氢氯钾钠银 二价氧钙钡镁锌 三铝四硅五价磷 二三铁 二四碳 一至五价都有氮铜汞二价最常见 正一铜氢钾钠银正二铜镁钙钡锌 三铝四硅二四六硫二四五氮三五磷 一五七氯二三铁二四六七锰为正 碳有正四与正二再把负价牢记心 负一溴碘与氟氯负二氧硫三氮磷
初中常见原子团化合价口决
负一硝酸氢氧根,负二硫酸碳酸根,还有负三磷酸根,只有铵根是正一 。
初中金属活动性顺序口诀
钾钙钠镁铝(嫁给那美女)、锌铁锡铅(薪贴七千)【氢】 铜汞银铂金(童工赢铂金) 【K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H) Cu、Hg、Ag、Pt、Au 】