新伟祥王艳丽 王艳丽课题组和章新政课题组合作发现病毒对抗CRISPR/Cas系统的结构基础
2016年9月2日,《Cell Research》在线发表了中科院生物物理研究所王艳丽研究组和章新政研究组合作的研究论文,题为“A CRISPR evolutionary arms race: structural insights into viral anti-CRISPR/Cas responses”。该研究解析了AcrF3以及AcrF3-Cas3复合物的结构,阐述了AcrF3在对抗CRISPR/Cas系统发挥的作用,揭示了病毒与细菌在长期进化中形成的相互拮抗的作用机制。
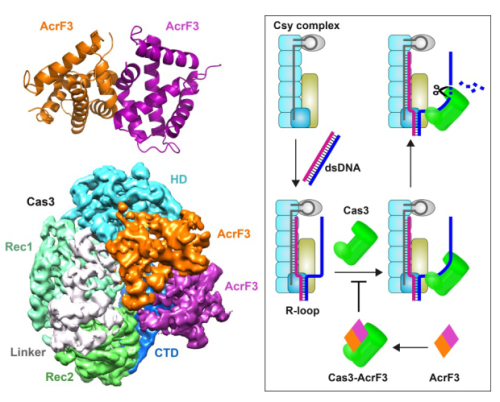
细菌和古菌等原核生物不断地遭受外界病毒的入侵,成簇而规律的间隔短回文重复序列(CRISPR)及其辅助蛋白(Cas)共同构筑了原核生物一道重要的免疫防线—CRISPR/Cas系统。然而,CRISPR/Cas系统并不能完全清除入侵的病毒,这表明有些病毒已经进化出对抗该免疫系统的手段。早期研究发现,某些入侵铜绿假单胞菌的噬菌体的基因中能够编码蛋白对抗CRISPR/Cas系统,研究人员称之为AcrF蛋白。其中,AcrF3蛋白能够结合宿主中具有核酸酶活性的Cas3蛋白,阻碍Cas3蛋白与Csy复合体结合形成干扰复合体,从而使噬菌体的DNA逃出被CRISPR/Cas系统降解的厄运。
为了研究AcrF蛋白抑制CRISPR/Cas系统的分子机制,王艳丽研究组和章新政研究组通力合作,解析了AcrF3的高分辨率晶体结构与AcrF3-Cas3复合物的冷冻电镜结构。研究人员通过对结构的分析发现,AcrF3无论是在自由条件下还是在与Cas3形成复合物时,都以二体形式存在,两个AcrF3分子分别与Cas3的N端和C端相互作用,这样就封闭了单链DNA进入Cas3的入口,使得Cas3无法被结合了外源DNA的Csy复合体招募,导致入侵的噬菌体DNA不能被CRISPR/Cas系统清除。
此外,在铜绿假单胞菌新间隔序列的获取阶段需要Cas1、Cas2、Cas3和Csy复合体共同参与,又称为引发-获取阶段,由于AcrF3结合Cas3,占据了DNA的入口,Cas3将不能产生前体间隔序列,因此获取阶段也将受到严重的影响。
该项研究不仅阐明了AcrF3对抗CRISPR/Cas系统的作用机制,还对病毒与宿主共同进化在分子层面提供了新的见解。
该项研究主要由王艳丽课题组的副研究员王久宇和章新政课题组的博士后马军共同完成,王艳丽研究员和章新政研究员为本文的共同通讯作者。该研究得到科技部、国家自然科学基金、中国科学院战略性先导科技专项(B类)以及国家“青年千人计划”的资助,上海光源和生物物理研究所生物成像中心为该研究提供了重要的技术支持。
文章链接
图示:左图为AcrF3的晶体结构及AcrF3-Cas3的电镜结构,右图为AcrF3抑制CRISPR/Cas系统的模式图。