清华大学颜宁最新Nature文章
生物通报道 近日来自清华大学的颜宁教授课题组发表了题为“Crystal structure of an orthologue of the NaChBac voltage-gated sodium channel”的文章,报道了细菌电压门控钠通道NaChBac同源物的晶体结构。相关研究成果公布在Nature杂志上。
电压门控钠(Nav)通道是神经和肌肉快速去极化的必不可少的条件,也是重要的药物靶点。确定Nav通道的结构将揭示离子通道的机制,推动潜在的临床应用。细菌Nav通道家族,举例来说细菌的Na+选择性通道(NaChBac)为结构功能分析提供了一个有用的模型系统。
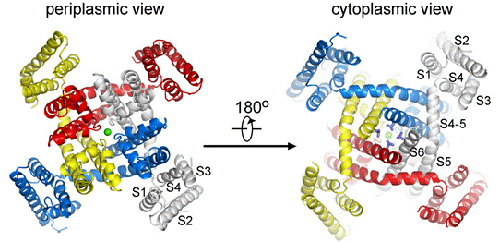
在这篇文章中,研究人员报告了来自海洋α-变形菌(Alphaproteobacterium)HIMB114的NaChBac同源物NavRh高达3.05埃的高分辨率的晶体结构。通过对三维晶体结构的分析,研究人员发现该通道包含了一个不对称的四聚体。
Thr 178和 Leu 179的碳基氧原子构成了晶体结构中水合Ca2+定位的选择性过滤器的内部位点。由Ser 181 和 Glu 183所决定的Na+选择性过滤器的外口被关闭,是孔道细胞内侧的激活门。
电压传感蛋白采纳了一种去极化的构象,其中所有的门控电荷均暴露于细胞外环境下。研究人员认为NavRh处于一种“失活”构象中。比较NavRh和NavAb4揭示出相当大的构象重排有可能是电压门控通道电机械耦合机制的基础。
这些新研究发现为未来进一步解析电压门控性离子通道的功能和机制提供了重要的框架。
2007年不满30岁的普林斯顿大学博士颜宁,受聘清华大学医学院教授,成为清华最年轻的教授、博士生导师。在回国的几年间,颜宁教授研究组主要聚焦于膜蛋白,胆固醇代谢调控通路相关因子的结构生物学研究,发表了多篇重要的论文。
进入2012年颜宁课题组捷报频传。今年1月,她与施一公教授联合报道了转录激活因子样效应蛋白(TALE)特异识别DNA的分子机理,这提供了TALE蛋白的改造基础,极大地拓宽了TALE蛋白在生物技术应用上的前景。相关成果公布在Science杂志上,并被作为亮点推荐文章。
不久前,颜宁课题组还在JBC杂志上发表论文报道了拟南芥ABA信号通路中的一种关键调控因子:SnRK2.6的激酶位点结晶结构,并从中发现了一种ABA信号转导新机制,这将加深我们对于ABA下游信号通路的理解。